Proteínas y Enzimas
1.1 Proteínas
Las proteínas son biomoléculas orgánicas compuestas por C, H, O, N, S y formadas por una o varias cadenas polipeptídicas que resultan de la unión, mediante enlaces peptídicos, de un elevado número de aminoácidos.
1.2 Aminoácidos y Enlace Peptídico
Los aminoácidos son las unidades estructurales o monómeros de las proteínas. Están formados por un carbono alfa al que se encuentran unidos un grupo amino (-NH₂), un grupo carboxilo (-COOH), un átomo de hidrógeno y una cadena lateral o radical variable (-R).
- Aminoácidos con radicales no polares (hidrófobos): glicina, alanina, valina, prolina, leucina, isoleucina, metionina.
- Aminoácidos aromáticos: fenilalanina, triptófano, tirosina.
- Aminoácidos con radicales polares (hidrofílicos) y carga positiva (básicos): lisina, histidina, arginina.
- Aminoácidos con radicales polares (hidrofílicos) y carga negativa (ácidos): ácido aspártico, ácido glutámico.
- Aminoácidos con radicales polares (hidrofílicos) sin carga: glutamina, serina, cisteína, asparagina, treonina.
Propiedades y Características de los Aminoácidos
- Sólidos, cristalinos, no hidrolizables e incoloros. Sabor dulce.
- Isomería óptica: El carbono alfa es asimétrico, lo que les confiere actividad óptica. La posición del grupo amino nos permite diferenciar entre la forma D y la forma L. La glicina es el único que no tiene isomería óptica.
- Carácter anfótero: Gracias al grupo carboxilo pueden comportarse como ácidos y, gracias a su grupo amino, pueden comportarse como bases. Este comportamiento dependerá del pH del medio en el que se encuentre.
Enlace Peptídico
Es el tipo de enlace que se establece entre el grupo carboxilo de un aminoácido y el grupo amino de otro aminoácido, con la pérdida de una molécula de H₂O. Se caracteriza por ser covalente, tener un carácter de doble enlace parcial (evita la rotación a su alrededor) y una estructura coplanar.
La unión de dos aminoácidos mediante enlace peptídico se conoce como dipéptido:
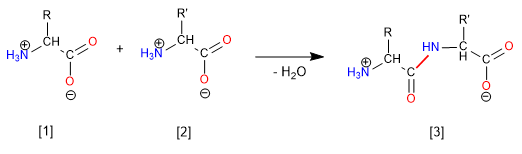
Nota: La liberación de una molécula de H₂O procede de la pérdida del -OH del grupo carboxilo de un aminoácido y la pérdida de un H del grupo amino del otro aminoácido.
1.3 Niveles Estructurales de las Proteínas
Estructura Primaria
Secuencia lineal y ordenada de aminoácidos unidos mediante enlaces peptídicos.
Estructura Secundaria
La estructura primaria se pliega en el espacio, estableciéndose puentes de hidrógeno. Característica de las proteínas fibrosas.
- Conformación alfa-hélice: Estructura helicoidal. La cadena polipeptídica se enrolla en forma de hélice gracias a los puentes de hidrógeno entre aminoácidos no consecutivos, de manera que las cadenas laterales de los aminoácidos quedan hacia fuera de la hélice.
- Conformación beta (lámina beta): Estructura laminar. Fragmentos de la misma cadena polipeptídica o de distintas cadenas se disponen en paralelo en forma de línea quebrada, de fuelle o de zig-zag. Las cadenas polipeptídicas se unen por puentes de hidrógeno transversales, de manera que las cadenas laterales de los aminoácidos se disponen hacia arriba y hacia abajo de la lámina plegada.
Estructura Terciaria
La estructura secundaria sufre plegamientos en el espacio producidos por interacciones entre las cadenas laterales de los aminoácidos. Es característica de cada proteína y suelen presentarla proteínas globulares. Se establecen puentes de hidrógeno, interacciones electrostáticas, interacciones hidrofóbicas, puentes disulfuro y fuerzas de Van der Waals entre los radicales de la propia cadena polipeptídica.
Estructura Cuaternaria
Unión de dos o más cadenas polipeptídicas con estructura terciaria. Se establecen puentes de hidrógeno, interacciones electrostáticas, hidrofóbicas, puentes disulfuro y fuerzas de Van der Waals entre los radicales de las distintas cadenas polipeptídicas.
1.4 Propiedades y Características de las Proteínas
Desnaturalización
Pérdida (reversible o irreversible) de la estructura secundaria, terciaria y cuaternaria debido a la rotura de las interacciones que las mantienen unidas. Puede producirse a causa de alteraciones como cambios drásticos de pH o temperatura y conlleva la pérdida de la funcionalidad de la proteína. El proceso por el cual la proteína puede recuperar su conformación y funcionalidad se denomina renaturalización.
Especificidad
Son específicas debido a que cada aminoácido ocupa una posición concreta en la secuencia lineal de la proteína que condicionará la estructura terciaria y cuaternaria y, con ello, la función que desempeñe.
Solubilidad
Las proteínas ricas en aminoácidos con radicales polares son más solubles, ya que establecen puentes de hidrógeno con las moléculas de agua. Las proteínas pequeñas y globulares son mucho más solubles que las grandes y fibrosas.
Capacidad Amortiguadora
Tienen un comportamiento anfótero que les permitirá amortiguar las variaciones del pH del medio.
1.5 Clasificación de las Proteínas
Holoproteínas
Formadas exclusivamente por aminoácidos:
- Proteínas fibrosas: Suelen estar ordenadas a lo largo de una sola dimensión con una estructura secundaria bien definida. Son insolubles en agua, con funciones de protección o estructurales (ej. Colágeno, miosina).
- Proteínas globulares: Tienen una estructura más o menos esférica debida al plegamiento de su estructura secundaria. Son solubles en agua y disoluciones polares, y se relacionan con funciones importantes para la actividad celular (ej. Actina, globulinas).
Heteroproteínas
Formadas por la unión de una parte proteica (aminoácidos) y otras moléculas no proteicas (grupo prostético):
- Cromoproteínas: (pigmento) hemoglobina
- Nucleoproteínas: (ácido nucleico) proteínas asociadas a ARN en ribosomas
- Glucoproteínas: (glúcido) fibrinógeno
- Fosfoproteínas: (ácido fosfórico) caseína
- Lipoproteínas: (lípido) LDL
1.6 Funciones de las Proteínas
- Catálisis o enzimática: Llevada a cabo por las enzimas.
- Estructural: Proporcionan fuerza, protección y soporte mecánico a las estructuras biológicas.
- Defensa inmunitaria: Los anticuerpos encargados de la defensa inmunológica, reconociendo a los antígenos.
- Reguladora y hormonal: Integración y coordinación de procesos bioquímicos.
- Transporte: En el plasma sanguíneo (transporta lípidos), entre otros.
- Homeostática: Mantener constantes los valores de determinadas variables del medio interno. Las proteínas pueden actuar como tampones.
- Movimiento y contractilidad: Permiten a las células o estructuras desplazarse o cambiar de forma.
- Nutrición y reserva: Almacenar ciertos compuestos químicos para utilizarlos como elementos nutritivos o en la formación del embrión en crecimiento.
- Reconocimiento de señales: En la superficie exterior están los receptores, que son los encargados del reconocimiento de señales químicas.
2. Enzimas
2.1 Enzimas
Proteínas con función catalítica. Como catalizadores:
- Aumentan la velocidad de las reacciones bioquímicas mediante la disminución de la energía de activación.
- Se liberan y se recuperan al final de la reacción sin alterar las variables termodinámicas de estado, como la entalpía o la energía libre de Gibbs.
Estructura de las Enzimas
La región de la enzima por la que se une al sustrato se conoce como centro activo. De este centro activo depende la especificidad de la enzima, puesto que posee una configuración complementaria a la del sustrato: los aminoácidos del centro activo conforman una estructura complementaria al sustrato. Es lo que se conoce como el famoso modelo de «llave-cerradura».
Las holoenzimas no son exclusivamente proteínas, sino que la apoenzima (parte proteica) se asocia a componentes no proteicos (cofactor enzimático) necesarios para la acción de la enzima. Los cofactores enzimáticos pueden ser de diferente naturaleza, tales como cationes metálicos o moléculas orgánicas más complejas (coenzimas), como el NADH, FADH₂…
Estos cofactores y coenzimas son importantes porque intervienen en determinadas reacciones enzimáticas, permitiendo que estas puedan desarrollarse, ya que actúan como activadores de la función enzimática o transfiriendo grupos químicos.
| Hidrolasas | Hidrólisis (rotura de enlaces mediante agua) |
| Liasas | Rotura sin agua |
| Transferasas | Transferencia de radicales o grupos funcionales |
| Isomerasas | Isomerización (de moléculas a isómeros) |
| Oxidorreductasas | Oxidación-reducción |
| Ligasas | Formación de enlace de dos moléculas con hidrólisis de ATP |
2.2 Mecanismo de Acción y Cinética Enzimática
El sustrato se une a la enzima a través del centro activo de esta, produciendo la formación del complejo enzima-sustrato. La enzima cataliza la reacción hasta que se liberan los productos y esta queda libre y recuperada tal como estaba al principio.
Durante este proceso, la enzima (catalizador) aumenta la velocidad de la reacción mediante la disminución de la energía de activación.
La cinética de reacción de las enzimas sigue una curva de saturación, es decir, llega un momento en el que, aunque se aumente la concentración de sustrato, la velocidad deja de aumentar. Inicialmente, existe un crecimiento exponencial de la velocidad de acuerdo con el aumento de la concentración de sustrato, pero posteriormente se llega a una meseta generada por la saturación de enzimas (punto de saturación).
Esto se debe a que todas las enzimas están ocupadas por moléculas de sustrato y, hasta que la enzima no se desocupe, no podrá entrar otra molécula de sustrato. La Vmax hace referencia a la velocidad máxima de reacción característica de una enzima a una concentración dada. La Km corresponde a la concentración de sustrato a la cual se alcanza la mitad de la Vmax.
2.3 Regulación de la Actividad Enzimática
Concentración de Sustrato
El aumento de la concentración de sustrato aumenta la velocidad de reacción hasta el punto de saturación.
pH
La variación de pH por encima o por debajo del valor óptimo de cada enzima (aquel en el que la actividad enzimática es máxima), provoca un descenso de la velocidad de reacción por dificultar la unión del sustrato al centro activo. Un pH extremo podría causar la desnaturalización de la enzima y cesaría su actividad.
¡Ojo! Algunas enzimas tienen su actividad óptima a pH extremos.
Temperatura
Una temperatura por encima o por debajo del valor óptimo de cada enzima provoca un descenso de la velocidad de reacción. Una temperatura extrema podría causar la desnaturalización de la enzima y cesaría su actividad.
Inhibidores Enzimáticos
Sustancias que anulan o disminuyen la actividad enzimática:
- Inhibición irreversible: El inhibidor establece enlaces covalentes con la enzima, impidiendo de manera definitiva su actividad. Este tipo de inhibición es característica de algunos venenos.
- Inhibición reversible: El inhibidor establece enlaces débiles con la enzima, por lo que se puede disociar de ella, permitiendo de nuevo su actividad.
- Competitiva: Inhibidor y sustrato compiten por el centro activo de la enzima. La enzima puede unirse al inhibidor por similitud con el sustrato (inhibición competitiva por análogo).
- No competitiva: El inhibidor se une a la enzima, generando una modificación en el centro activo que impide al sustrato unirse y, por tanto, que se lleve a cabo la reacción.